前言骨在人體內(nèi)部主要起到支撐作用��,是一種具有愈合和再生能力的硬組織[1]��。由于骨的密度大��、硬度高��、破損后很難自然修復(fù)等特殊性��,必須進(jìn)行骨移植��。鈦合金因具有輕質(zhì)��、彈性模量與人骨相近��、耐腐蝕��、生物相容性好等優(yōu)點[2?3]��,被廣泛應(yīng)用于工程機(jī)械��、航空航天和生物醫(yī)學(xué)領(lǐng)域[4]。但是TC4基體對于金黃色葡萄球菌的抗菌率僅為14.5%[5]��,且鈦及鈦合金具有生物惰性��,與骨骼機(jī)械結(jié)合的方式會導(dǎo)致摩擦產(chǎn)生碎屑��,最終引發(fā)炎癥��,從而導(dǎo)致植入手術(shù)失敗[6]��。相對于在提高鈦合金種植體材料的骨結(jié)合��、耐磨性和耐蝕性方面的研究��,針對鈦合金骨科植入體細(xì)菌感染的研究仍處于早期階段[7]��。
植入手術(shù)術(shù)后感染是植入失敗的主要原因之一��,細(xì)菌引起的相關(guān)植入物感染風(fēng)險從0.4%到16.1%不等[8]��。引起細(xì)菌感染的重要原因是生物膜的形成[9]及由粘附的微生物聚集產(chǎn)生致密的胞外聚合物[10]��。因此��,防止或降低生物膜在植入過程中的形成具有重要作用��。
目前,對于提高鈦及鈦合金植入材料抗菌性能的表面改性途徑包括涂覆抗生素��、制備有機(jī)抗菌劑和無機(jī)抗菌劑涂層等技術(shù)來達(dá)到滅菌的作用[11]��。研究發(fā)現(xiàn)��,鈦合金表面制備依諾沙星涂層[12]��、慶大霉素-HA涂層[13]��、膦酸鹽/季銨鹽共聚物涂層[14]等有機(jī)抗菌劑涂層對鈦合金的抗菌性能都有較大程度的提高��。但是��,抗生素��、有機(jī)抗菌劑的大量使用會導(dǎo)致細(xì)菌產(chǎn)生耐藥性且藥物作用時間較短[15]��。無機(jī)抗菌劑主要包括Ag+��,Cu2+��,Zn2+��,Co2+等��,能夠在人體內(nèi)穩(wěn)定發(fā)揮作用且具有優(yōu)良的抗菌性能和生物相容性��。目前��,在鈦合金中添加無機(jī)抗菌金屬元素的技術(shù)主要包括電弧熔煉��、真空等離子燒結(jié)��、離子注入��、氣相沉積和激光表面改性技術(shù)等��,將無機(jī)抗菌劑摻入合金體系或者表面��,使植入材料獲得抗菌性能��。其中��,激光表面改性技術(shù)具有獨特的技術(shù)優(yōu)勢��,相對于電沉積��、PVD/CVD技術(shù)��,與基體材料具有較強(qiáng)的結(jié)合力��。相對于熱噴涂技術(shù),具有較小的熱影響區(qū)[16]��,對基材的影響較小��。因此��,激光表面改性技術(shù)具有廣闊的應(yīng)用潛力��。
激光表面改性技術(shù)既可以通過高溫?zé)嵩磳Ρ砻孢M(jìn)行重熔引發(fā)合金相轉(zhuǎn)變或構(gòu)建表面紋理化來提高表面性能��,又可以結(jié)合外源物質(zhì)制備具有不同性能的表面涂層[17]��。激光作為一種新型能源��,具有局部選擇性��、能量密度高��、節(jié)省材料��、凝固快��、稀釋率低��、熱影響區(qū)窄��、冶金結(jié)合強(qiáng)度高等優(yōu)點[18]��,也可以對合金的組織形態(tài)和析出相進(jìn)行調(diào)控[19]��,被廣泛應(yīng)用于材料加工領(lǐng)域��。激光表面改性技術(shù)作為一種無機(jī)抗菌劑植入技術(shù)��,在表面工程中具有廣泛的應(yīng)用前景��。
鈦及鈦合金作為主要的骨科植入材料��,其抗菌性的研究成為重中之重��,如何利用激光表面改性技術(shù)��,改善植入物的抗菌性能成為現(xiàn)階段的研究熱點��。文中綜述了激光表面改性技術(shù)的分類��,以及采用激光表面改性技術(shù)對鈦及鈦合金進(jìn)行表面合金化��、表面織構(gòu)和激光熔覆處理��,研究激光表面改性方式對鈦合金抗菌性能的影響并對抗菌機(jī)理進(jìn)行解釋��。
1、激光表面改性技術(shù)
激光表面改性技術(shù)利用激光熱源與金屬或非金屬進(jìn)行相互作用��,通過添加相同或不同材料或?qū)Σ牧媳砻孢M(jìn)行重熔來改善基體的表面性能��,是一種清潔��、安全��、高效率的加工技術(shù)[20]��,是光學(xué)��、冶金學(xué)��、電子學(xué)��、計算機(jī)學(xué)等為一體的高新技術(shù)��,在現(xiàn)階段具有廣闊的應(yīng)用前景��。
激光表面改性技術(shù)主要包括表面硬化��、激光重熔��、織構(gòu)化和激光熔覆等��,分類如圖1所示��。
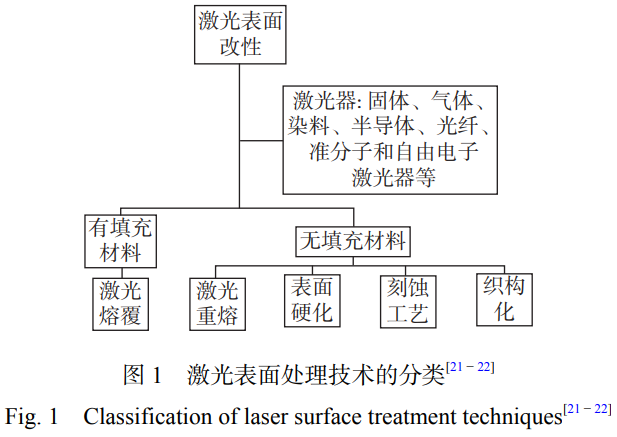
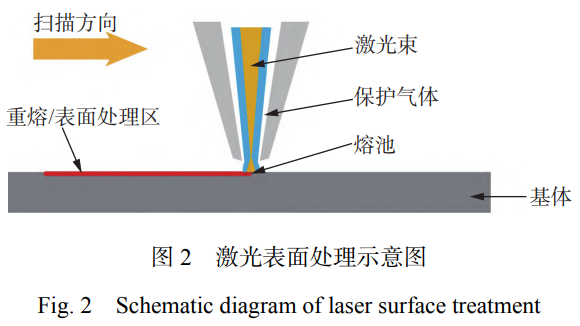
激光表面處理技術(shù)在保護(hù)氣氛或者無保護(hù)氣條件下對材料進(jìn)行表面加熱或重熔��,可以對材料表面進(jìn)行定向處理��,其原理如圖2所示��。激光表面處理包括激光重熔��、激光合金化��、激光紋理化和激光微納加工等技術(shù)��。固體材料在受到激光束的作用下��,有助于通過誘導(dǎo)微觀結(jié)構(gòu)變化來進(jìn)一步提高抗菌性能��、表面硬度��、耐磨性��、耐腐蝕性等性能��,從而實現(xiàn)表面改性[23]��。同時,激光表面處理可應(yīng)用于制備微納加工結(jié)構(gòu)��、改善金屬表面性能和加強(qiáng)固體材料粘結(jié)強(qiáng)度等方面��。
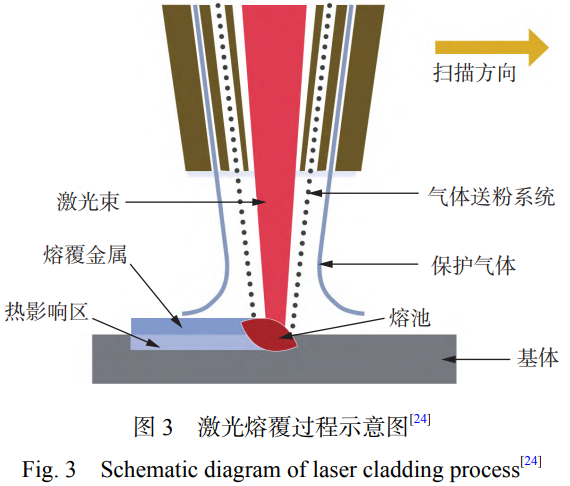
激光熔覆技術(shù)是利用激光束的高能量密度��,將基體材料熔化形成熔池��,由保護(hù)氣體攜帶金屬粉末或絲材同時注入熔池��,從而將其熔覆在受熱區(qū)域表面��,形成具有冶金結(jié)合的功能性涂層��,提高材料的表面性能��,其原理如圖3[24]所示��。激光熔覆技術(shù)是上世紀(jì)90年代以來快速發(fā)展的表面改性技術(shù)��,現(xiàn)階段已經(jīng)得到廣泛應(yīng)用[18]��。激光熔覆技術(shù)具有熱輸入能量集中��、熱影響區(qū)小��、變形小��、基體能夠與熔覆層形成冶金結(jié)合��、熔覆層稀釋率低等優(yōu)點[25?26]��。激光熔覆技術(shù)主要應(yīng)用于提高基體耐磨性��、耐蝕性��、抗菌性和耐高溫性能等[27]��。
2��、激光表面處理鈦合金抗菌涂層
激光本質(zhì)上是電磁波的一種��,按照波長可分為紫外光��、可見光和紅外光[28]��。根據(jù)激光器功率的不同��,選擇不同波長的激光對鈦及鈦合金進(jìn)行處理?�,F(xiàn)階段,波長小于355nm的短波長激光可以對鈦及鈦合金進(jìn)行切割��;波長為532nm的綠光激光多用在醫(yī)療領(lǐng)域?qū)︹伡扳伜辖鸺す饧庸ぬ幚?�。激光表面處理技術(shù)主要通過改變鈦合金的表面化學(xué)成分和表面結(jié)構(gòu)��,對鈦合金植入物的抗菌性能進(jìn)行調(diào)控��。
在激光表面處理過程中��,由于合金元素��、表面結(jié)構(gòu)和熔覆體系的不同��,對激光表面處理鈦及鈦合金的結(jié)構(gòu)和性能有不同程度的影響��,從而達(dá)到不同的抗菌效果��。
2.1 激光表面合金化
激光表面合金化技術(shù)(LSA)是利用激光熱源將基材熔化形成熔池��,將高性能合金粉或氣體與基體發(fā)生反應(yīng)形成一層新的合金化層��,從而使材料具有高性能[29]��。
通過激光表面合金化技術(shù)在合金表面添加適當(dāng)含量的抗菌元素��,可改變材料表面的合金成分��。同時��,由于激光能量可以熔化涂層和部分底層基體��,激光表面合金化技術(shù)可以在合金層和基體之間形成牢固的冶金結(jié)合��。QIAO等學(xué)者[30]使用波長較短(0.9μm)的高功率二極管激光器制備了TiNi與Ag的激光合金化涂層��。研究表明:通過合金化技術(shù)可以使涂層中含有更多的Ti2Ni��,β-Ti和Ag顆粒��;在銀含量(質(zhì)量分?jǐn)?shù))為4.6%時��,涂層的硬度提高了109%��;同時��,合金化后涂層釋放的Ag+和Ag顆粒顯著提高了對大腸桿菌和金黃色葡萄球菌的抗菌效果��。
在激光處理過程中��,保護(hù)氣體不僅可以降低空氣中氧氣和水分等對激光表面處理的干擾和污染��,提高表面處理的質(zhì)量和效率[31],還可以與基體發(fā)生反應(yīng)��,形成合金化涂層��。由于氮和鈦在熱力學(xué)上存在有利的相互作用��,形成的氮化層對鈦合金的硬度和摩擦學(xué)性能有很大的提高[32]��。鈦的氮化物(TiN)��、氧化物(TiO2)等[31]都具有本征抗菌性能��。鄒潔等學(xué)者[33]在牙科鈷鉻合金表面制備一層2.5μm厚度的TiN涂層��,之后對涂層進(jìn)行耐腐蝕和抗菌性試驗��,發(fā)現(xiàn):TiN涂層對變形鏈球菌或黏性放線菌有很好的抗菌性能��。
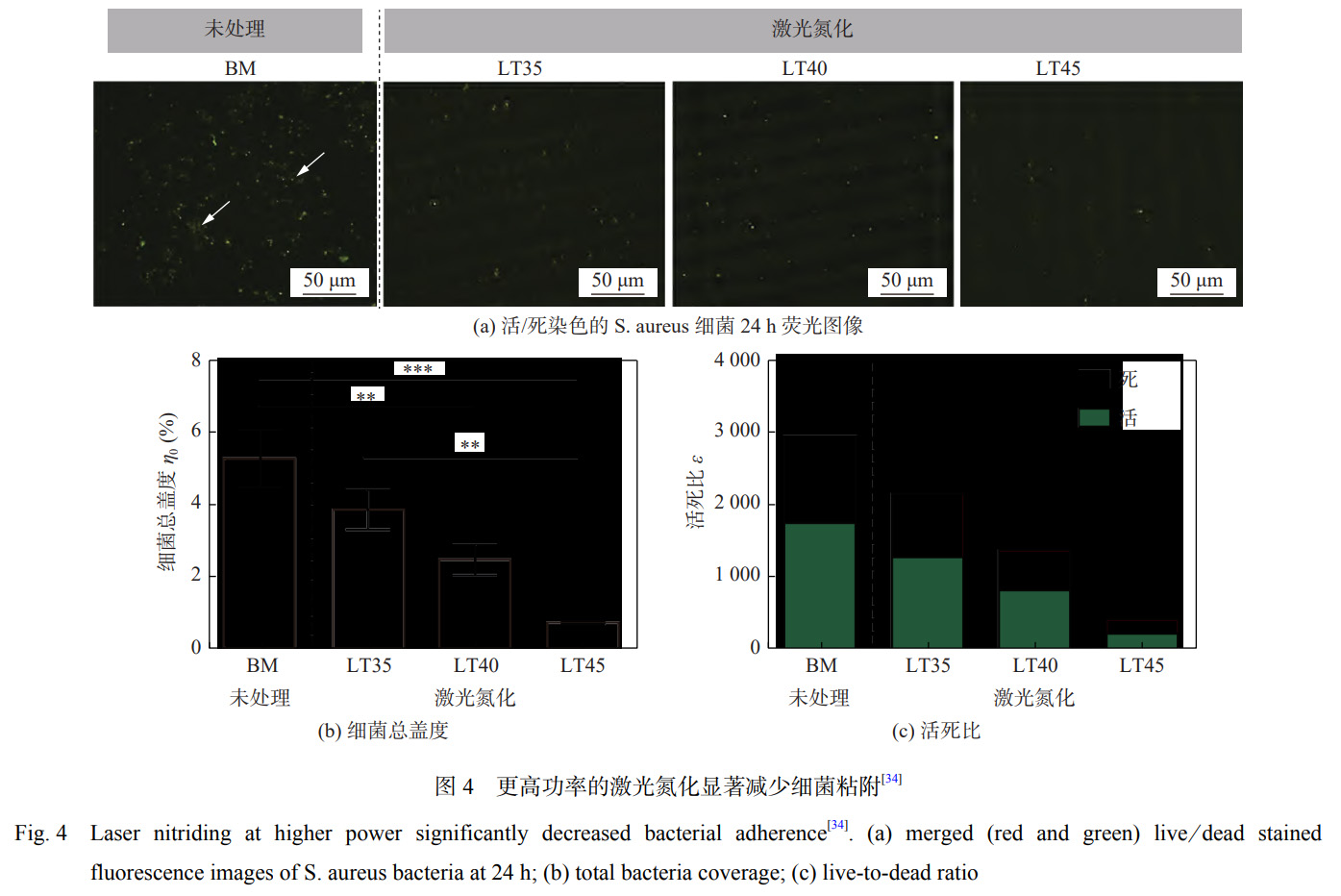
DONAGHY等學(xué)者[34]利用光纖激光技術(shù)在高純N2保護(hù)下對TNZT(Ti-35Nb-7Zr-6Ta)合金進(jìn)行處理��,研究激光氮化處理對合金表面形貌��、粗糙度��、潤濕角以及抗菌性能的影響��。結(jié)果表明:激光氮化處理后XRD檢測到較強(qiáng)的TiN峰值強(qiáng)度,能夠顯著提高表面粗糙度至1180.2nm��,潤濕角降低至27.1°��,親水性和生物相容性進(jìn)一步提高��,其抗菌效果如圖4[34]所示��,合金表面細(xì)菌覆蓋率降低至0.72%��。
鈦及鈦合金相對于其他材料抗菌和耐腐蝕的主要優(yōu)點是可以在表面生成一層TiO2陶瓷膜[35]��。研究表明:鈦合金在正常溫度下暴露1年��,所形成的TiO2氧化膜的厚度為6nm��,且與基體結(jié)合性很差��,在較低的剪切力作用下就會被破壞[7]��。激光表面處理可以改變氧化膜的厚度和表面粗糙度��,進(jìn)而提高合金的性能��。
FATHI-HAFSHEJANI等學(xué)者[36]在氧氣氛圍內(nèi)對鈦合金進(jìn)行激光表面改性處理��,鈦合金基體表面形成物相和形貌可控的高純度TiO2涂層��。由于晶體TiO2涂層產(chǎn)生的光催化活性��,具有不同相(銳鈦礦��、金紅石)和不同形態(tài)的TiO2涂層在增強(qiáng)骨整合和抗菌行為方面表現(xiàn)出優(yōu)異的性能��。PARMAR等學(xué)者[37]通過對TC4進(jìn)行納秒激光和氧化處理��。研究表明:納秒激光處理表面發(fā)生微坑形式的物理和化學(xué)變化��,表面電荷發(fā)生變化��,Ti的氧化物含量增加��,氧化可以促進(jìn)激光微織構(gòu)對金黃色葡萄球菌的粘附和增殖能力的抑制��。
鈦與空氣中的碳��、氫等都有非常高的反應(yīng)活性��。CUNHA等學(xué)者[38]在空氣中對鈦進(jìn)行激光表面處理��,在進(jìn)行XPS檢測時��,發(fā)現(xiàn)其有較高的碳峰,原因是空氣中含有較多的含碳污染物[39]��。氬氣作為一種常見的惰性保護(hù)氣體��,其多用于激光焊接和激光熔覆過程中防止有益元素的燒損和合金化[40]��,在鈦及鈦合金表面激光處理用以提高抗菌性能中的應(yīng)用較少��。
2.2 激光表面織構(gòu)
激光表面織構(gòu)技術(shù)可以對鈦合金進(jìn)行表面結(jié)構(gòu)設(shè)計或者進(jìn)行重熔處理��,改善鈦及鈦合金的表面結(jié)構(gòu)?�,F(xiàn)階段��,通過激光表面織構(gòu)技術(shù)可以在鈦及鈦合金表面制備微米和納米尺寸的結(jié)構(gòu)或紋理結(jié)構(gòu)��,進(jìn)而影響合金表面的氧化膜厚度和表面粗糙度��,降低表面載流子數(shù)量��、提高表面峰度��,有效地減少細(xì)菌的黏附或滅活細(xì)菌[41]��。
納米級表面特征有利于減少細(xì)菌黏附和生長��。CHAN等學(xué)者[7]通過連續(xù)波光纖激光器發(fā)射波長為1064nm近紅外激光對商業(yè)純鈦(cp-Ti)和TC4進(jìn)行激光表面處理誘導(dǎo)納米特征結(jié)構(gòu)的產(chǎn)生��,其處理后表面如圖5所示��。激光處理表面由波紋和放射狀片層構(gòu)成的玫瑰狀標(biāo)記組成��,2種鈦合金均表現(xiàn)出較強(qiáng)的抗菌性能��。從表面疏水性��、膜成分��、厚度和粗糙度等方面對抗菌機(jī)理進(jìn)行解釋:①研究發(fā)現(xiàn)��,金黃色葡萄球菌是疏水性的��,其水接觸角為72.2°[42]��,而經(jīng)過激光處理的表面表現(xiàn)出更強(qiáng)的親水性��,水接觸角降低到30°~45°��,減少了細(xì)菌的接觸��。②細(xì)菌與植入物表面接觸是在表面電荷與細(xì)菌的靜電相互作用下進(jìn)行吸引,使細(xì)菌黏附在植入物表面��,在氮氣環(huán)境中進(jìn)行激光表面處理會增大表面膜層的厚度��,減少表面載流子的數(shù)量[43]��。同時��,表面膜層中存在大量的缺陷和空位��,會造成電荷的富集��,減少與細(xì)菌的相互作用[7]��。③激光表面織構(gòu)會增加材料的表面粗糙度��,相同的表面粗糙度具有不同的峰度(Rku)和偏度(Rsk)[44]��,激光處理的鈦合金表面具有更高的峰度和偏度��,使表面有更多的“尖刺”��,減少細(xì)菌黏附的原理與蟬翼的殺菌作用相似[45]��,通過細(xì)菌與材料的相互作用將其吸附在表面��,導(dǎo)致細(xì)菌的破裂和裂解��。

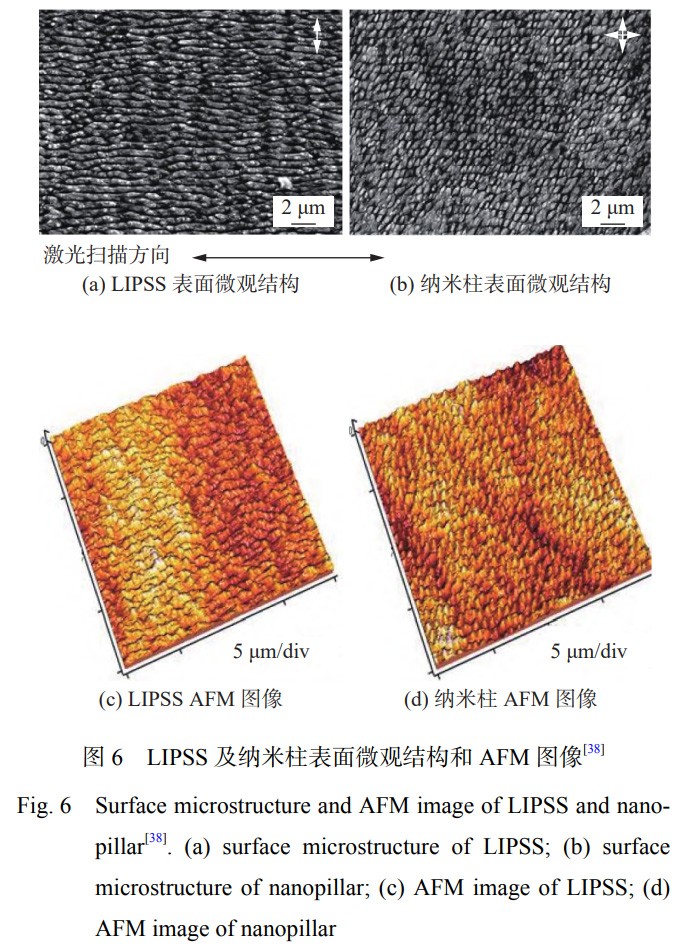
CUNHA等學(xué)者[38]采用Yb:KYW激光器��、發(fā)射波長為1030nm��、脈沖持續(xù)時間為500fs的激光��,在鈦合金表面構(gòu)建了激光誘導(dǎo)周期性表面紋理結(jié)構(gòu)(LIPSS)和納米柱2種表面織構(gòu)��,其表面結(jié)構(gòu)如圖6所示��,其Ra值分別為0.3μm和0.5μm��,潤濕角分別為12.6°和32.1°��。對其進(jìn)行細(xì)菌培養(yǎng)試驗��,未經(jīng)激光處理試樣表面細(xì)菌覆蓋率為25%��,激光處理后試樣表面金黃色葡萄球菌的覆蓋率為7%��,對于細(xì)菌的生長有較好的抑制作用��。研究表明:金黃色葡萄球菌優(yōu)先附著于1~4nm的鈦合金表面[46]��,在Ra為5~8μm的樣品上形成的生物膜比在拋光(Ra=30nm)或機(jī)加工(Ra=0.5μm)表面上更強(qiáng)烈[47]��。細(xì)菌優(yōu)先粘附在粗糙度較高的表面��,但也粘附在形貌特征大于細(xì)菌尺寸(一般為1~2μm)的表面��。因此��,激光誘導(dǎo)周期性表面紋理結(jié)構(gòu)可以通過改善鈦合金表面的潤濕角和粗糙度降低細(xì)菌的黏附和增殖��。
綜上所述��,激光表面處理后鈦及鈦合金表面結(jié)構(gòu)對于減少細(xì)菌的黏附主要包括兩方面:一是通過構(gòu)建具有特征尺寸小于細(xì)菌尺寸和具有非常致密的特征表面��,減少細(xì)菌與表面的接觸面積��,抑制細(xì)菌的定植或刺破細(xì)菌��,達(dá)到減少細(xì)菌滯留的目的��;二是通過增大表面的凹陷程度��,細(xì)菌無法穿過凹陷與表面建立穩(wěn)定的連接��,導(dǎo)致細(xì)菌只能黏附在個別的尖端��,防止生物膜的形成��。
2.3 激光熔覆抗菌涂層
激光熔覆技術(shù)可以在鈦及鈦合金表面熔覆不同體系的成分��,改善鈦合金的性能?�,F(xiàn)階段��,激光熔覆技術(shù)用于提高鈦及鈦合金抗菌性能的熔覆體系主要包括生物醫(yī)用金屬材料(Ag��,Cu��,Nb��,Zn��,Ta等[48])��、生物陶瓷(HA��,TiO2等[49])��。激光熔覆技術(shù)可以顯著提高鈦及鈦合金的抗菌性能��,尤其是對金黃色葡萄球菌和大腸桿菌等常見的致病菌有較好的抑制作用[50]��。
2.3.1 Ag抗菌涂層
Ag具有超強(qiáng)的抗菌性,被廣泛應(yīng)用于廣譜殺菌材料��。SHI等學(xué)者[51]通過對高真空電弧爐熔煉的TiAg合金進(jìn)行抗菌性試驗��,發(fā)現(xiàn):合金的抗菌性是由于Ti2Ag和Ag+的共同作用��,且沒有引起細(xì)胞毒性��。CHEN等學(xué)者[52]制成的Ti-Ag合金在經(jīng)過熱處理后��,對金黃色葡萄球菌的抑制率高達(dá)99%��。表明:Ag的加入可以使合金獲得較強(qiáng)且穩(wěn)定的抗菌性能��。
XUE等學(xué)者[53]通過激光熔覆技術(shù)在Ti-20Zr10Nb-4Ta表面激光熔覆Ag箔��,研究Ag微粒對于鈦合金抗菌性和相容性的影響��,試驗結(jié)果表明:當(dāng)激光功率為50W和70W時��,經(jīng)過處理的表面對于大腸桿菌的抑菌率分別達(dá)到96.3%和98.2%��,對于金黃色葡萄球菌的抑菌率均達(dá)到100%��,且隨著激光功率的增加��,表面形成了鈍化膜��,粗糙度增大��,具有良好的耐腐蝕性能和生物相容性��。ZHANG等學(xué)者[54]將Ag和ZnO納米顆粒摻入羥基磷灰石納米粉體中��,通過激光熔覆技術(shù)沉積在TC4表面��,對激光熔覆涂層的抗菌性能和骨整合性能進(jìn)行研究��。研究發(fā)現(xiàn):納米Ag和HA在熔覆層表面呈棒狀��,涂層與基體結(jié)合良好��,最大熔深達(dá)到460μm��,涂層的最小潤濕角約為10.5°��。激光熔覆可以將復(fù)合涂層緊密地固定在TC4基體上��,抑制了Ag離子的釋放速率��,緩解了高Ag濃度下的細(xì)胞毒性[55],涂層具有優(yōu)異的細(xì)菌抗性��、成骨和骨整合能力��。MAHARUBIN等學(xué)者[56]通過激光加工凈成形工藝將混合均勻的cp-Ti粉和Ag粉采用同步送粉方式在cp-Ti基體上制備銀含量(質(zhì)量分?jǐn)?shù))為0.5%~2.0%的Ti-Ag合金��,通過EDS檢測發(fā)現(xiàn):Ag均勻地分布在基體上��。通過對不同Ag含量的試樣進(jìn)行金黃色葡萄球菌和銅綠假單胞菌進(jìn)行抗菌性試驗��,抗菌效果隨Ag含量的增加而增強(qiáng)��,當(dāng)Ag含量達(dá)到1.5%時��,抗菌率分別達(dá)到99.79%和99.96%��,且在Ag含量較低時��,可以在不損害生物活性的前提下最小化細(xì)菌感染的風(fēng)險��。
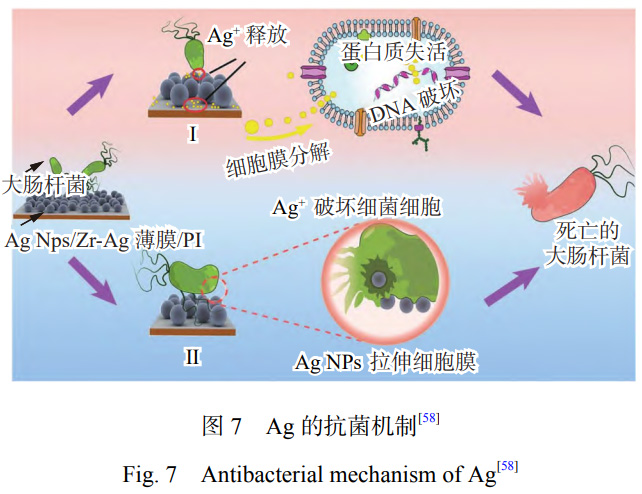
目前��,關(guān)于Ag對微生物的抑制和殺傷途徑主要歸結(jié)為以下觀點[57]��,其抗菌原理如圖7[58]所示��。Ag能夠抗菌的主要原因是能被菌類吸附,帶正電荷的Ag+能與帶負(fù)電荷的微生物之間產(chǎn)生靜電吸引��,從而促使Ag+附著在細(xì)胞膜上[59]��,細(xì)菌的細(xì)胞膜在與Ag接觸幾分鐘后就會被完全破壞[60]��。同時��,Ag能夠與細(xì)菌的蛋白質(zhì)相互結(jié)合��,破壞蛋白質(zhì)的結(jié)構(gòu)��,阻礙細(xì)菌的新陳代謝��,從而失去活性[61]��。Ag+濃度的提高會導(dǎo)致細(xì)胞氧化反應(yīng)的增加��,微生物細(xì)胞氧化應(yīng)激的增加是Ag+引起毒性作用的標(biāo)志��。由于Ag能夠促進(jìn)細(xì)胞產(chǎn)生ROS和自由基��,因此Ag具有強(qiáng)大的抗菌��、抗真菌和抗病毒活性[62]��。但是��,抗菌性能與銀含量不存在線性關(guān)系��,銀含量過高時��,并不會顯著提高鈦合金的抗菌性能��,反而可能產(chǎn)生細(xì)胞毒性[63]��。
2.3.2 Cu抗菌涂層
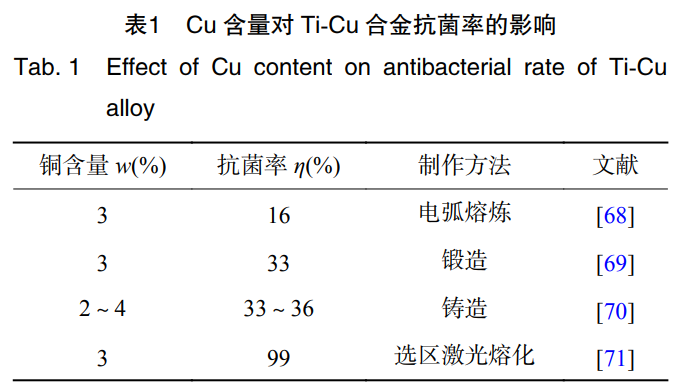
不同的金屬材料殺菌能力也有所不同��,其大小排序為:Cu>Fe>Sn>Al>Zn>Co[64]��。Cu具有促進(jìn)成骨細(xì)胞分化��,誘導(dǎo)血管生長的作用��。同時��,作為人體必需的微量元素��,有預(yù)防骨質(zhì)疏松的作用[65]。ZHANG等學(xué)者[66]通過采用等離子燒結(jié)技術(shù)制備的Ti-Cu合金對大腸桿菌和金黃色葡萄球菌的抑制率達(dá)到99%��。有研究報道��,只有Ti-Cu合金的Cu含量(質(zhì)量分?jǐn)?shù))在5%及以上��,合金才具有抗菌率>99%的抗菌性能[67]��,表1為合金中Cu含量不同表現(xiàn)出的抗菌性能[68-71]��。
JI等學(xué)者[72]采用激光選區(qū)熔化技術(shù)制備的Ti-(3,5,7,10)Cu合金(質(zhì)量分?jǐn)?shù)��,%)��,Ti2Cu相在晶界預(yù)先形核并阻止晶粒長大��,能夠很好的起到細(xì)化晶粒的作用��。同時��,由于激光選區(qū)熔化快速凝固的特點��,Ti的平均晶粒尺寸為7.4μm��,遠(yuǎn)小于常規(guī)鑄造Ti的晶粒尺寸��,快速凝固導(dǎo)致表面收縮而產(chǎn)生的細(xì)小孔洞��,增加了細(xì)菌與合金的接觸面積��,抗菌效果明顯增加��。合金具有較小的Cu2+釋放且有較高的抗菌率��。Ti-Cu合金與細(xì)菌細(xì)胞膜的直接相互作用導(dǎo)致膜的滲透性增強(qiáng)��,細(xì)菌允許Cu2+進(jìn)入細(xì)胞內(nèi)��,引起接觸殺菌[73]��。經(jīng)過激光選區(qū)熔化形成的Ti-3Cu合金的抗菌率相對于相同成分的鑄造合金��,抗菌率提高約70%��。
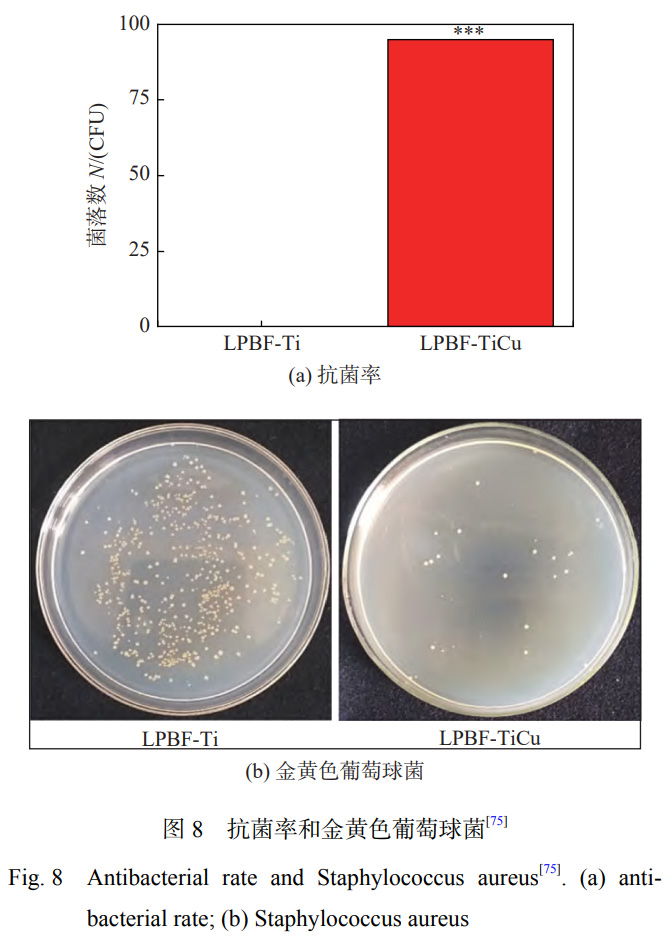
HOU等學(xué)者[74]通過激光熔覆技術(shù)在TC4表面原位制備摻雜Cu顆粒的Ca-Si基涂層��,研究表明:激光處理后原位生成了Ca2SiO4��,CaTiO3和Cu2O��,涂層表現(xiàn)出良好的耐磨性和潤濕性��;當(dāng)Cu含量達(dá)到15%時,復(fù)合涂層具有對大腸桿菌最高的抗菌活性��。LIU等學(xué)者[75]利用激光粉末床熔合(LPBF)技術(shù)在純鈦基體上制備抗菌Ti-Cu合金(LPBF-TiCu)��,激光快速加熱和冷卻的優(yōu)點相對于傳統(tǒng)方法制作的Ti-Cu合金��,會使Ti合金形成較多的針狀馬氏體(α′-Ti)��,由于其具有較低的能量狀態(tài)��,會減緩鈦合金的腐蝕[76]��。Cu的加入改善了LPBF-TiCu合金中馬氏體相變時形狀應(yīng)變的自適應(yīng)性��,減少了位錯在晶界的堆積��。LPBFTiCu合金可以顯著促進(jìn)細(xì)胞的增殖��,合金表面上的細(xì)胞具有更多的偽足��,生物相容性良好��,對金黃色葡萄球菌的抑制率達(dá)到94.81%��,抗菌效果如圖8所示��。
目前��,關(guān)于激光熔覆含Cu涂層多用于改變金屬的耐磨性和耐腐蝕性[77?78]��,對于采用激光熔覆方式引入Cu提高植入物抗菌性能的研究較少?�,F(xiàn)階段關(guān)于Cu2+的殺菌機(jī)理主要解釋為含銅的抗菌金屬材料在溶液或體液環(huán)境下溶出會釋放帶正電的Cu2+離子��,而細(xì)菌的生物膜通常帶負(fù)電荷��,二者之間會產(chǎn)生吸附作用��,從而導(dǎo)致細(xì)胞膜上的電荷分布不均勻��,細(xì)菌形態(tài)在不均勻的庫侖力作用下發(fā)生變形��,細(xì)胞膜的滲透性改變��,最終造成細(xì)菌壁和細(xì)菌膜的破裂��,導(dǎo)致細(xì)胞質(zhì)的溶出��,從而殺死細(xì)菌[79]��。
3��、結(jié)束語
(1)激光表面改性誘導(dǎo)鈦合金產(chǎn)生抗菌涂層的調(diào)控機(jī)理尚不明確,以及如何提升抗菌涂層制造技術(shù)的精確性��,促進(jìn)抗菌性和生物相容性更加協(xié)調(diào)��,是現(xiàn)階段鈦合金激光表面改性的研究重點��。
(2)雖然Ag��,Cu等抗菌元素的抗菌性已經(jīng)得到驗證��。但是��,目前對于金屬離子的抗菌機(jī)制及細(xì)胞毒性機(jī)制的研究尚不明確��。不論是通過構(gòu)建含有抗菌元素的抗菌涂層還是合金化處理��,都需要保證植入物的長期無害性��。因此��,可以在保證抗菌元素的最小添加量下��,同時加入多種微量抗菌元素��。
(3)對于鈦及鈦合金的發(fā)展��,仍然需要對引發(fā)炎癥和細(xì)菌感染方面投入大量研究��。鈦合金的植入要在保證對人體組織長期無害的前提下��,構(gòu)建穩(wěn)定且多功能的復(fù)合涂層以滿足實際應(yīng)用中的多種需求��,是鈦及鈦合金在生物醫(yī)用領(lǐng)域中未來研究的主要方向��。
參考文獻(xiàn)
[1]POU P, RIVEIRO A, DEL VAL J, et al. Laser surface texturing of titanium for bioengineering applications[J].Procedia Manufacturing, 2017, 13: 694 ? 701.
[2]DU PLOOY R, AKINLABI E T. Analysis of laser cladding of titanium alloy[J]. Materials Today: Proceedings, 2018, 5(9): 19594 ? 19603.
[3]孫壯, 王偉, 王成, 等. 鈦合金表面激光熔覆耐磨和自潤滑 涂層的研究進(jìn)展 [J]. 材料保護(hù), 2023, 56(1): 107 ? 120.
SUN Zhuang, WANG Wei, WANG Cheng, et al. Research progress of wear-resistant and self-lubrication coatings prepared on titanium alloy surface by laser cladding[J]. Material Protection, 2023, 56(1): 107 ? 120.
[4]LIU S Y, SHIN Y C. Additive manufacturing of Ti6Al4V alloy: A review[J]. Materials & Design, 2019, 164: 107552.
[5] 吳耀佳, 張懋達(dá), 付永強(qiáng), 等. 含 Ag 硬質(zhì)涂層的結(jié)構(gòu)及其 摩擦腐蝕與抗菌特性的研究進(jìn)展 [J]. 表面技術(shù), 2021, 50(1): 94 ? 106, 161.
WU Yaojia, ZHANG Maoda, FU Yongqiang, et al. Research progress in structure, tribocorrosion and antibacterial properties of Ag-containing hard coatings[J]. Surface Technology, 2021, 50(1): 94 ? 106, 161.
[6]APAZA-BEDOYA K, TARCE M, BENFATTI C A M, et al. Synergistic interactions between corrosion and wear at titanium-based dental implant connections: A scoping review[J]. Journal of Periodontal Research, 2017, 52(6): 946 ? 954.
[7]CHAN C W, CARSON L, SMITH G C, et al. Enhancing the antibacterial performance of orthopaedic implant materials by fibre laser surface engineering[J]. Applied Surface Science, 2017, 404: 67 ? 81.
[8]ZIMMERLI W. Clinical presentation and treatment of orthopaedic implant-associated infection[J]. Journal of Internal Medicine, 2014, 276(2): 111 ? 119.
[9]CAMPOCCIA D, MONTANARO L, ARCIOLA C R. The significance of infection related to orthopedic devices and issues of antibiotic resistance[J]. Biomaterials, 2006, 27(11): 2331 ? 2339.
[10]FLEMMING H C, VAN HULLEBUSCH E D, NEU T R. The biofilm matrix: multitasking in a shared space[J].Nature Reviews Microbiology, 2023, 21(2): 70 ? 86.
[11]范競一, 馬迅, 李偉, 等. 醫(yī)用鈦合金表面改性技術(shù)研究進(jìn) 展 [J]. 功能材料, 2022, 53(7): 7027 ? 7039.
FAN Jingyi, MA Xun, LI Wei, et al. Research progress of surface modification technology of biomedical titanium alloy[J]. Journal of Functional Materials, 2022, 53(7): 7027 ? 7039.
[12]NIE Bin’en, LONG Teng, AO Haiyong, et al. Covalent immobilization of enoxacin onto titanium implant surfaces for inhibiting multiple bacterial species infection and in vivo methicillin-resistant staphylococcus aureus infection prophylaxis[J]. Antimicrobial Agents and Chemotherapy, 2016, 60(1): e01766 ? 16.
[13]ALT V, BITSCHNAU A, ?STERLING J, et al. The effects of combined gentamicin-hydroxyapatite coating for cementless joint prostheses on the reduction of infection rates in a rabbit infection prophylaxis model[J].Biomaterials, 2006, 27: 4627 ? 4634.
[14]DONG Yaning, LIU Li, SUN Jin, et al. Phosphonate/quaternary ammonium copolymers as high-efficiency antibacterial coating for metallic substrates[J]. Journal of Materials Chemistry B, 2021, 9(39): 8321 ? 8329.
[15] 秦思民. 基于生物被膜的耐藥性抗菌劑研究和工程新材 料探索 [D]. 北京: 中國科學(xué)院大學(xué), 2022.
QIN Simin. Research on drug-resistant antibacterial agents and exploration of new engineering materials based on biofilms[D]. Beijing, China: University of Chinese Academy of Sciences, 2022.
[16]王東生, 田宗軍, 沈理達(dá), 等. 激光熔覆技術(shù)研究現(xiàn)狀及其 發(fā)展 [J]. 應(yīng)用激光, 2012, 32(6): 538 ? 544.
WANG Dongsheng, TIAN Zongjun, SHEN Lida, et al. Research status and development of laser cladding technology[J]. Applied Laser, 2012, 32(6): 538 ? 544.
[17]崔振鐸, 朱家民, 姜輝, 等. Ti 及鈦合金表面改性在生物醫(yī) 用領(lǐng)域的研究進(jìn)展 [J]. 金屬學(xué)報, 2022, 58(7): 837 ? 856.
CUI Zhenduo, ZHU Jiamin, JIANG Hui, et al. Research progress of the surface modification of titanium and titanium alloys for biomedical application[J]. Acta Metallurgica Sinica, 2022, 58(7): 837 ? 856.
[18]SIDDIQUI A A, DUBEY A K. Recent trends in laser cladding and surface alloying[J]. Optics & Laser Technology, 2021, 134: 106619.
[19]JU Jiang, ZAN Rui, SHEN Zhao, et al. Remarkable bioactivity, bio-tribological, antibacterial, and anti-corrosion properties in a Ti6Al4V-xCu alloy by laser powder bed fusion for superior biomedical implant applications[J].Chemical Engineering Journal, 2023, 471: 144656.
[20]張永康, 周建忠, 葉會霞, 等. 激光加工技術(shù) [M]. 北京: 化 學(xué)工業(yè)出版社, 2006.
ZHANG Yongkang, ZHOU Jianzhong, YE Huixia, et al. Laser processing technology [M]. Beijing, China: Chemical Industry Press, 2006.
[21]SYPNIEWSKA J, SZKODO M. Influence of laser modification on the surface character of biomaterials: Titanium and its alloys-A review[J]. Coatings, 2022, 12: 1371.
[22]LIU Zhifang, NIU Tong, LEI Yaxi, et al. Metal surface wettability modification by nanosecond laser surface texturing: A review[J]. Biosurface and Biotribology, 2022(2): 95 ? 120.
[23]XU Yong, LIU Wei, ZHANG Gangqiang, et al. Friction stability and cellular behaviors on laser textured Ti6Al4V alloy implants with bioinspired micro-overlapping structures[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2020, 109: 103823.
[24] WANG Xinlin, LEI Lei, YU Han. A review on microstructural features and mechanical properties of wheels/rails cladded by laser cladding[J]. Micromachines, 2021, 12(2): 152.
[25] ZHANG Yifu, ZHANG Hua, ZHU Zhengqiang, et al.Microstructure, properties and first principles calculation of titanium alloy/steel by Nd: YAG laser self-fluxing welding[J]. China Welding, 2018, 27(3): 1 ? 10.
[26]周佳良, 舒鳳遠(yuǎn), 趙洪運, 等. 激光熔覆在 AlN 陶瓷表面制 備銅基金屬覆層缺陷分析及控制 [J]. 焊接學(xué)報, 2019, 40(11): 133 ? 138.
ZHOU Jialiang, SHU Fengyuan, ZHAO Hongyun, et al. Analysis and control of defects in preparing copper-based metal coatings on AlN ceramic surface by laser cladding[J].Transactions of the China Welding Institution, 2019, 40(11): 133 ? 138.
[27]袁慶龍, 馮旭東, 曹晶晶, 等. 激光熔覆技術(shù)研究進(jìn)展 [J].材料導(dǎo)報, 2010, 24(3): 112 ? 116.
YUAN Qinglong, FENG Xudong, CAO Jingjing, et al. Research progress of laser cladding technology[J]. Materials Reports, 2010, 24(3): 112 ? 116.
[28]王垚. 噴射電沉積前處理的激光表面處理方法與試驗研 究 [D]. 南京: 南京航空航天大學(xué), 2019.
WANG Yao. Experimental Study on Laser surface treatment method of pre-electrodeposition[D]. Nanjing, China: Nanjing University of Aeronautics and Astronautics, 2019.
[29]林基輝, 劉德鑫, 李耀, 等. 激光合金化技術(shù)在表面改性中 的應(yīng)用研究進(jìn)展 [J]. 熱加工工藝, 2020, 49(8): 13 ? 16.
LIN Jihui, LIU Dexin, LI Yao, et al. Research Progress in application of laser alloying technology in surface modification[J]. Hot Working Technology, 2020, 49(8): 13 ? 16.
[30]QIAO Q, CRISTINO V A M, TAM L M, et al. Characterization of laser surface-alloyed Ti-Ni-Ag coatings and evaluation of their corrosion and antibacterial performance[J]. Surface and Coatings Technology, 2023, 474: 130119.
[31]CHAN C W, LEE S, SMITH G, et al. Enhancement of wear and corrosion resistance of beta titanium alloy by laser gas alloying with nitrogen[J]. Applied Surface Science, 2016, 367: 80 ? 90.
[32]SANTOS E C, MORITA M, SHIOMI M, et al. Laser gas nitriding of pure titanium using CW and pulsed Nd: YAG lasers[J]. Surface and Coatings Technology, 2006, 201: 1635 ? 1642.
[33]鄒潔, 陳潔, 胡濱. TiN 涂層對牙科鈷鉻合金抗菌腐蝕性能 的影響 [J]. 上?�?谇会t(yī)學(xué), 2010, 19(2): 173 ? 177.
ZOU Jie, CHEN Jie, HU Bin. Effect of titanium nitride coating on bacterial corrosion resistance of dental Co-Cr alloy[J]. Shanghai Journal of Stomatology, 2010, 19(2): 173 ? 177.
[34] DONAGHY C L, MCFADDEN R, KELAINI S, et al. Creating an antibacterial surface on beta TNZT alloys for hip implant applications by laser nitriding[J]. Optics & Laser Technology, 2020, 121: 105793.
[35]肖憶楠, 喬巖欣, 李月明, 等. 醫(yī)用鈦及鈦合金表面改性技 術(shù)的研究進(jìn)展 [J]. 材料導(dǎo)報, 2019, 33(Z2): 336 ? 342.
XIAO Yinan, QIAO Yanxin, LI Yueming, et al. Research development of surface modification technology of biomedical titanium and titanium alloy[J]. Materials Reports, 2019, 33(Z2): 336 ? 342.
[36]FATHI-HAFSHEJANI P, JOHNSON H, AHMADI Z, et al. Phase-selective and localized TiO2 coating on additive and wrought titanium by a direct laser surface modification approach[J]. ACS Omega, 2020, 5(27): 16744 ? 16751.
[37]PARMAR V, KUMAR A, SANKAR M M, et al. Oxidation facilitated antimicrobial ability of laser micro-textured titanium alloy against gram-positive Staphylococcus aureus for biomedical applications[J]. Journal of Laser Applications, 2018, 30(3): 032001.
[38]
CUNHA A, ELIE A M, PLAWINSKI L, et al. Femtosecond laser surface texturing of titanium as a method to reduce the adhesion of Staphylococcus aureus and biofilm formation[J]. Applied Surface Science, 2016, 360: 485 ? 493.
[39]VARIOLA F, YI J H, RICHERT L, et al. Tailoring the surface properties of Ti6Al4V by controlled chemical oxidation[J]. Biomater, 2008, 29(10): 1285 ? 1298.
[40]李華晨, 周廣濤, 陳梅峰, 等. 分步氣體介質(zhì)下低功率激光 焊接薄板紫銅成形及組織和性能 [J]. 焊接學(xué)報, 2020, 41(10): 65 ? 72.
LI Huachen, ZHOU Guangtao, CHEN Meifeng, et al. Research on laser welding formability and microstructure property of copper in stepwise gas medium[J]. Transactions of the China Welding Institution, 2020, 41(10): 65 ? 72.
[41]GALLARDO-MORENO A M, PACHA-OLIVENZA M A, SALDA?A L, et al. In vitro biocompatibility and bacterial adhesion of physico-chemically modified Ti6Al4V surface by means of UV irradiation[J]. Acta Biomaterialia, 2009, 5(1): 181 ? 192.
[42]MITIK-DINEVA N, WANG J, TRUONG V K, et al. Escherichia coli, Pseudomonas aeruginosa, and Staphylococcus aureus attachment patterns on glass surfaces with nanoscale roughness[J]. Current Microbiology, 2009, 58: 268 ? 273.
[43] JEYACHANDRAN Y L, NARAYANDASS S K. The effect of thickness of titanium nitride coatings on bacterial adhesion[J]. Trends in Biomaterials and Artificial Organs, 2010, 24(2): 90 ? 93.
[44] GIRALDEZ M J, RESUA C G, LIRA M, et al. ContactLens hydrophobicity and roughness effects on bacterial adhesion[J]. Optometry and Vision Science, 2010, 87(6): E426 ? E431.
[45]POGODIN S, HASAN J, BAULIN V A, et al. Biophysical model of bacterial cell interactions with nanopatterned cicada wing surfaces[J]. Biophysical Journal, 2013, 104(4): 835 ? 840.
[46]TRUONG V K, LAPOVOK R, ESTRIN Y S, et al. The influence of nano-scale surface roughness on bacterial adhesion to ultrafine-grained titanium[J]. Biomaterials, 2010, 31(13): 3674 ? 3683.
[47]BRAEM A, VAN MELLAERT L, MATTHEYS T, et al. Staphylococcal biofilm growth on smooth and porous titanium coatings for biomedical applications[J]. Journal of Biomedical Materials Research Part A, 2014, 102: 215 ? 224.
[48]司銀芳, 胡語婕, 張凡, 等. 生物合成氧化鋅納米顆粒材料 及其抗菌應(yīng)用 [J]. 化工進(jìn)展, 2023, 42(4): 2013 ? 2023.
SI Yinfang, HU Yujie, ZHANG Fan, et al. Biosynthesis of zinc oxide nanoparticles and its application to antibacterial[J]. Chemical Industry and Engineering Progress, 2023, 42(4): 2013 ? 2023.
[49]許晴. 生物活性陶瓷復(fù)合材料制備及其抗菌和再生修復(fù) 研究 [D]. 北京: 中國科學(xué)院大學(xué), 2021.
XU Qing. Preparation of bioactive ceramic composites and its antibacterial activity and regenerative repair effect[D]. Beijing, China: University of Chinese Academy of Sciences, 2021.
[50]ZHOU Yazhou, YANG Juan, HE Tingting, et al. Highly stable and dispersive silver nanoparticle-graphene composites by a simple and low-energy-consuming approach and their antimicrobial activity[J]. Small, 2013, 9(20): 3445 ? 3454.
[51]SHI Anqi, ZHU Chenshun, FU Shan, et al. What controls the antibacterial activity of Ti-Ag alloy, Ag ion or Ti2Ag particles?[J]. Materials Science and Engineering: C, 2020, 109: 110548.
[52]CHEN Mian, YANG Lei, ZHANG Lan, et al. Effect of nano/micro-Ag compound particles on the bio-corrosion, antibacterial properties and cell biocompatibility of Ti-Ag alloys[J]. Materials Science and Engineering: C, 2017, 75: 906 ? 917.
[53]XUE Xianda, LU Libin, HE Donglei, et al. Antibacterial properties and cytocompatibility of Ti-20Zr-10Nb-4Ta alloy surface with Ag microparticles by laser treatment[J]. Surface and Coatings Technology, 2021, 425: 27716.
[54] ZHANG Yanzhe, LIU Xiangmei, LI Zhaoyang, et al. Nano Ag/ZnO-incorporated hydroxyapatite composite coatings: highly effective infection prevention and excellent osteointegration[J]. ACS Applied Materials & Interfaces, 2018, 10(1): 1266 ? 1277.
[55]丁婷婷. 含銀納米材料的制備��、抗菌性能及細(xì)胞毒性研 究 [D]. 長沙: 湖南大學(xué), 2020.
DING Tingting. Preparation, antibacterial properties and cytotoxicity of silver-containing nanomaterials[D]. Changsha, China: Hunan University, 2020.
[56]MAHARUBIN S, HU Y B, SOORIYAARACHCHI D. Laser engineered net shaping of antimicrobial and biocompatible titanium-silver alloys[J]. Materials Science and Engineering: C, 2019, 105: 110059.
[57]李波. 基于銀基納米復(fù)合生物材料靶向協(xié)同抗菌用于骨 感染治療 [D]. 上海: 東華大學(xué), 2022.
LI Bo. Targeted synergistic antibacterial based on silverbased nanocomposite biomaterials for bone infection treatment[D]. Shanghai, China: Donghua University, 2022.
[58]SHI Pengyan, SUN Haoliang, ZHANG Haoge, et al. Highly effective antibacterial properties of self-formed Ag nanoparticles/Zr-Ag granular films[J]. Applied Surface Science, 2023, 622: 156929.
[59]ABBASZADEGAN A, GHAHRAMANI Y, GHOLAMI A, et al. The effect of charge at the surface of silver nanoparticles on antimicrobial activity against gram-positive and gram-negative bacteria: A preliminary study[J]. Journal of Nanomaterials, 2015, 2015: 720654.
[60]RAFFI M, HUSSAIN F, BHATTI T M, et al. Antibacterial characterization of silver nanoparticles against E. coli ATCC15224[J]. Journal of Materials Science & Technology, 2008, 24(2): 192 ? 196.
[61]張俊敏. Ti-Ta-Ag 合金的放電等離子體燒結(jié)合成機(jī)理及 其性能研究 [D]. 昆明: 昆明理工大學(xué), 2022.
ZHANG Junmin. Study on the synthesis mechanism and properties of Ti-Ta-Ag alloy by spark plasma sintering[D]. Kunming, China: Kunming University of Science and Technology, 2022.
[62]KIM S, LEE H S, RYU D, et al. Antibacterial activity of silver-nanoparticles against Staphylococcus aureus and Escherichia coli[J]. Korean Journal of Microbiology & Biotechnology, 2011, 39(1): 77 ? 85.
[63]FENG Q L, WU J, CHEN G Q, et al. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 2000, 52(4): 662 ? 668.
[64]
羅娟. 納米 Ag-Cu 基抗菌材料的制備及其性能研究 [D].昆明: 昆明理工大學(xué), 2022.
LUO Juan. Preparation and properties of nano Ag-Cu based antibacterial materials[D]. Kunming, China: Kunming University of Science and Technology, 2022.
[65]SRIKANT P, REDDY C K, RAM N R. Metallic particulates for preparation of anti-bacterial preservation vassals and their applications-A review[J]. Materials Today: Proceedings, 2019, 18: 440 ? 444.
[66]ZHANG Erlin, FU Shan, WANG Ruoxian, et al. Role of Cu element in biomedical metal alloy design[J]. Rare Metals, 2019, 38(6): 476 ? 494.
[67]ZHANG Erlin, LI Shengyi, REN Jing, et al. Effect of extrusion processing on the microstructure, mechanical properties, biocorrosion properties and antibacterial properties of Ti-Cu sintered alloys[J]. Materials Science and Engineering: C, 2016, 69: 760 ? 768.
[68]LIU Jie, LI Fangbing, LIU Cong, et al. Effect of Cu content on the antibacterial activity of titanium-copper sintered alloys[J]. Materials Science and Engineering: C, 2014, 35: 392 ? 400.
[69]FOWLER L, JANSON O, ENGQVIST H, et al. Antibacterial investigation of titanium-copper alloys using luminescent Staphylococcus epidermidis in a direct contact test[J].Materials Science and Engineering: C, 2019, 97: 707 ? 714.
[70]BAO Mianmian, LIU Ying, WANG Xiaoyan, et al. Optimization of mechanical properties, biocorrosion properties and antibacterial properties of wrought Ti-3Cu alloy by heat treatment[J]. Bioactive Materials, 2018, 3(1): 28 ? 38.
[71]ZHANG Erlin, REN Jing, LI Shengyi, et al. Optimization of mechanical properties, biocorrosion properties and antibacterial properties of as-cast Ti-Cu alloys[J].Biomedical Materials, 2016, 11: 065001.
[72]JI Hairui, ZHAO Mingchun, XIE Bin, et al. Corrosion and antibacterial performance of novel selective-laser-melted (SLMed) Ti-xCu biomedical alloys[J]. Journal of Alloys and Compounds, 2021, 8644: 158415.
[73]PENG Cong, ZHANG Shuyuan, SUN Ziqing, et al. Effect of annealing temperature on mechanical and antibacterial properties of Cu-bearing titanium alloy and its preliminary study of antibacterial mechanism[J]. Materials Science andEngineering: C, 2018, 93: 495 ? 504.
[74]HOU Baoping, YANG Zhao, YANG Yuling, et al. In vitro bioactivity, tribological property, and antibacterial ability of Ca-Si-based coatings doped with cu particles in-situ fabricated by laser cladding[J]. Applied Physics A, 2018, 124: 256.
[75]LIU Hui, SHI Lizhen, LIU Huan, et al. Corrosion behavior of laser powder bed fusion prepared antibacterial Cu-bearing titanium alloy[J]. Materials Letters, 2023, 331: 133496.
[76]KASCHEL F R, KEAVENEY S, DOWLING D P. Comparison between continuous and modulated wave laser emission modes for the selective laser melting of Ti-6Al-4V: Dimensional accuracy, microstructure and mechanical behaviour[J]. Additive Manufacturing, 2022, 55: 102825.
[77]謝發(fā)勤, 何鵬, 吳向清, 等. 鈦合金表面激光熔覆技術(shù)的研 究及展望 [J]. 稀有金屬材料與工程, 2022, 51(4): 1514 ? 1524.
XIE Fanqin, HE Peng, WU Xiangqing, et al. Research and prospect of laser cladding technology on titanium alloy surface[J]. Rare Metal Materials and Engineering, 2022, 51(4): 1514 ? 1524.
[78]黃湘湘. 碳鋼表面激光熔覆鋁青銅合金組織和性能研究[D]. 上海: 上海交通大學(xué), 2019.
HUANG Xiangxiang. Microstructure and properties of laser cladded aluminum bronze coating on carbon steel[D]. Shanghai, China: Shanghai Jiao Tong University, 2019.
[79]王亞迪. 基于陽離子-π 作用的銅復(fù)合物的抗菌性能與機(jī) 理研究 [D]. 北京: 中國科學(xué)院大學(xué), 2020. WANG Yadi. Copper complexes based on cation-π interaction: Preparation characterization and antimicrobial activities[D]. Beijing, China: University of Chinese Academy of Sciences, 2020.
第一作者: 馬振��,博士��,副教授��;主要從事醫(yī)用鈦合金表面 改性的科研和教學(xué)工作��;已發(fā)表論文 20 余篇��;jmsdxmz@163.com��。通信作者: 牟立婷��,博士,副教授��;主要從事醫(yī)用生物材料 研究��;muliting@163.com��。
相關(guān)鏈接